12 May Ensayos de Teratogenicidad: Potencial del Pez Cebra para el cribado eficaz y preciso de fármacos
Las pruebas de teratogenicidad son un paso crucial en el desarrollo de fármacos para identificar sustancias que puedan causar defectos físicos o funcionales en embriones o fetos humanos. Tras la tragedia de la talidomida en los años 50 y 60, se hizo obligatorio evaluar el potencial de un fármaco para inducir defectos congénitos mediante ensayos teratogénicos. Con el creciente desarrollo de sustancias químicas para diversos fines, como tratamientos, cosméticos y aditivos alimentarios, ha aumentado considerablemente el número de compuestos que requieren ensayos de teratogenicidad.
Los ensayos convencionales con animales para evaluar la toxicidad para el desarrollo y la reproducción llevan mucho tiempo y son costosos y laboriosos. Por lo tanto, cada vez es más necesario desarrollar ensayos teratogénicos alternativos que sean rentables, ofrezcan un alto rendimiento, sean fáciles de realizar, proporcionen resultados reproducibles y se ajusten a los datos de mamíferos in vivo.
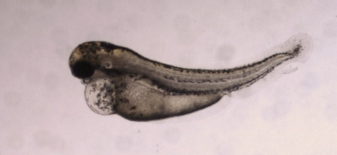
El modelo del pez cebra emerge como un candidato atractivo para la detección temprana de la toxicidad en el desarrollo de fármacos. El pez cebra es rentable y fácil de mantener, lo que permite el cribado de alto contenido (HCS) de fármacos candidatos. Además, el desarrollo del pez cebra se asemeja mucho al de los mamíferos, y muchas vías moleculares se conservan entre el pez cebra y los seres humanos, lo que los hace altamente predictivos de las respuestas de los mamíferos. Un ejemplo notable de ensayo de teratogenicidad de alto contenido es el ensayo Teratotox que ofrece Biobide.
Los teratógenos son sustancias que pueden causar defectos físicos o funcionales en embriones o fetos humanos cuando las mujeres embarazadas están expuestas a ellas. Estas sustancias pueden afectar al embrión o feto de diversas maneras, provocando malformaciones físicas, problemas de desarrollo en el comportamiento o las emociones, y defectos en el sistema nervioso que pueden dar lugar a discapacidad o retraso. Los teratógenos también pueden causar complicaciones durante el embarazo, como parto prematuro, abortos espontáneos o abortos espontáneos.
La polémica de la talidomida de los años 50 es un ejemplo bien conocido de toxicidad para el desarrollo. La talidomida, comercializada inicialmente en 46 países para tratar las náuseas matutinas, los resfriados y la gripe en mujeres embarazadas, provocó numerosas malformaciones congénitas. La ausencia de pruebas en mujeres embarazadas antes de su lanzamiento garantizó falsamente su seguridad hasta que nacieron niños deformes. Este incidente provocó cambios normativos, y la Food and Drug Administration (FDA) publicó directrices para evaluar la teratogenicidad, clasificando los fármacos en las clases A, B, C, D y X en función de sus riesgos asociados durante el embarazo. Los fármacos de las categorías D y X tienen efectos embriotóxicos y/o teratogénicos en humanos y animales. La Agencia Europea de Medicamentos (EMEA) tiene un sistema de clasificación similar, descrito en la directriz ICH S5(R3), para evaluar la toxicidad reproductiva en productos farmacéuticos humanos durante el descubrimiento y desarrollo de fármacos o antes de su comercialización.
Los ensayos tradicionales de teratogenicidad implican pruebas exhaustivas con animales de laboratorio preñados, como ratones, ratas, conejos y primates no humanos. Los compuestos de ensayo se administran diariamente durante el periodo de organogénesis fetal, y el feto se examina para detectar anomalías esqueléticas, viscerales y externas cerca del término. Sin embargo, estas pruebas son costosas, requieren mucho tiempo y contradicen la demanda de pruebas rápidas. Además, el público y los organismos reguladores presionan cada vez más para que se reduzca el uso de animales, lo que lleva a la necesidad de sistemas de ensayo alternativos.
Se han desarrollado modelos in vitro con células y tejidos como alternativa a los ensayos con animales, siguiendo el principio de las tres erres: sustitución, reducción y refinamiento. Entre ellos se encuentran los ensayos de cultivo de embriones enteros, los ensayos de teratógenos en cultivos de órganos y los sistemas de cultivo de células eucariotas. Sin embargo, los ensayos in vitro no suelen predecir los resultados in vivo de la absorción, distribución, metabolismo y excreción (ADME) de los fármacos.
El pez cebra ha ganado popularidad como modelo animal alternativo para ensayos in vivo de toxicidad de fármacos y sustancias químicas. Ofrecen ventajas significativas sobre los ensayos convencionales con mamíferos. Los embriones de pez cebra son de pequeño tamaño, muy fértiles y experimentan un rápido desarrollo y organogénesis, con la mayoría de los órganos desarrollados en las 120 horas posteriores a la fecundación. Esto permite períodos de ensayo más cortos, menores costes, cantidades más pequeñas de compuestos, fácil manipulación, administración directa de compuestos y escalabilidad para el cribado de alto contenido. Además, los experimentos con el pez cebra pueden llevarse a cabo durante el desarrollo embrionario bajo los principios de las 3R sin necesidad de aprobación por parte de los Comités Éticos. Su transparencia en la fase larvaria también permite procedimientos no invasivos.
Además, el pez cebra comparte similitudes en fisiología, desarrollo, metabolismo y vías con los mamíferos. Poseen ortólogos de una gran mayoría (86%) de las dianas farmacológicas humanas y comparten aproximadamente un 85% de homología con los humanos en cuanto a su genoma. Numerosos estudios han demostrado la alta predictibilidad de las respuestas del pez cebra a las sustancias tóxicas para las respuestas de los mamíferos.
Reconociendo el potencial del pez cebra como organismo experimental, los Institutos Nacionales de Salud (NIH) lo clasificaron en 2003 como el tercer organismo más importante después de las ratas y los ratones. Agencias reguladoras como la FDA y la EMEA también han aceptado los datos de evaluación de toxicidad y seguridad del pez cebra para la aprobación de fármacos, ofreciendo una alternativa a los modelos convencionales de cribado con roedores y conejos.
En comparación con otros modelos de vertebrados, el pez cebra completa la embriogénesis en las primeras 72 horas y desarrolla órganos y tejidos diferenciados a las 120 horas de la fecundación. Esto coincide con el periodo crítico de formación de órganos en las ratas. La predicción cuantitativa del potencial teratogénico de los compuestos en embriones de pez cebra puede lograrse mediante un sistema de puntuación basado en cambios fenotípicos, similar a las evaluaciones del desarrollo embrionario-fetal in vivo en mamíferos. El modelo del pez cebra sirve como modelo alternativo de toxicología del desarrollo para predecir efectos en humanos y puede complementarse con análisis de esperma para obtener información tanto sobre el desarrollo embrionario como sobre la espermatogénesis.
El ensayo Teratotox de Biobide en pez cebra es una herramienta valiosa para evaluar las propiedades teratogénicas de fármacos potenciales durante la fase preclínica temprana. Este ensayo ofrece un formato rentable y de alto contenido, produciendo resultados altamente transferibles a otros vertebrados y humanos. Se utilizan embriones de pez cebra que expresan una proteína verde fluorescente en el corazón en condiciones ambientales estrictas. Los embriones se tratan con compuestos de ensayo y se analizan diversos órganos y procesos para identificar malformaciones, defectos morfológicos, edema, tejido necrótico y otros criterios de valoración teratogénicos y tóxicos. Se calculan parámetros como EC50, LC50, Índice Teratogénico (TI) y valores NOAEL.
Pueden emplearse técnicas de análisis adicionales, incluida la evaluación de la biodisponibilidad mediante HPLC-MS/MS e histopatología, para investigar más a fondo la concentración interna de los compuestos de ensayo y garantizar resultados precisos. Al utilizar el pez cebra como paso intermedio entre la evaluación basada en células y los ensayos con animales mamíferos, el ensayo Teratotox mejora la velocidad, la rentabilidad y la precisión de la evaluación de la teratogenicidad en el desarrollo de fármacos.
En conclusión, los ensayos de teratogenicidad son un aspecto crucial del desarrollo de fármacos para garantizar la seguridad de los posibles medicamentos para las mujeres embarazadas y sus fetos en desarrollo. El modelo del pez cebra ofrece una alternativa prometedora a los ensayos tradicionales con mamíferos, ya que proporciona evaluaciones rentables, de alto rendimiento y predictivas de la toxicidad en el desarrollo. El uso del pez cebra en ensayos como el Teratotox Assay de Biobide constituye una valiosa herramienta para detectar defectos congénitos en los medicamentos y facilitar un desarrollo farmacéutico más seguro.



No Comments